
Badania prowadzone w Zakładzie Biotechnologii Medycznej

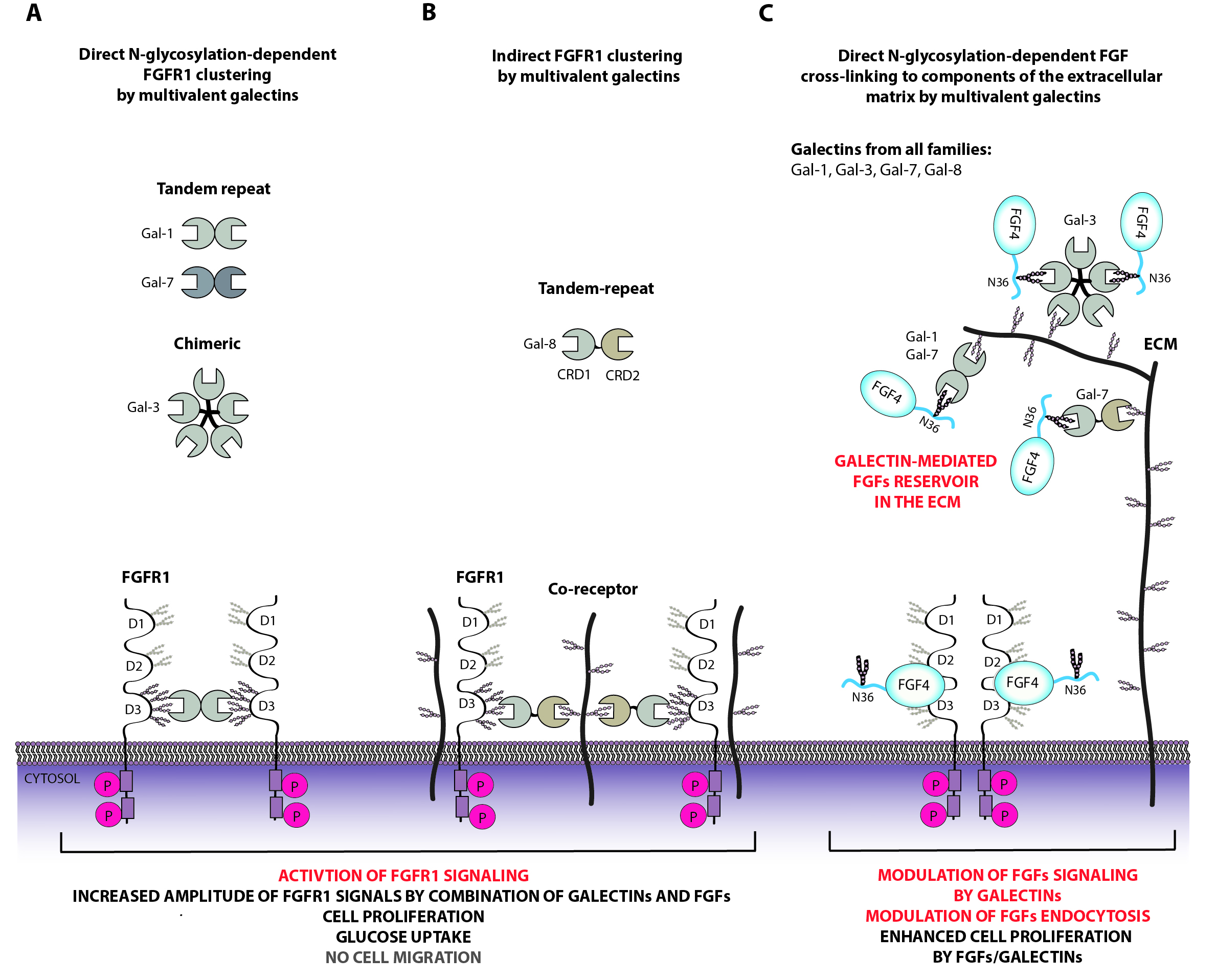
Galektyny są pektynami rozpoznającymi specyficznie cukry, w szczególności terminalną galaktozę na łańcuchach cuktorwtch dołączonych do białek czy lipidów. Galektyny biorą udział w wielu kluczowych procesach komórkowych (m.in. przekazywanie sygnałów, endocytoza, ekspresja genów, kontakty międzykomórkowe), pełnią też istotną rolę w inwazji komórek ludzkich przez patogeny, w odpowiedzi immunologicznej oraz w procesie nowotworzenia. Galektyny zbudowane są głównie z domeny rozpoznającej węglowodany CRD (z ang. Carbohydrate Recognition Domain), do której dołączone mogą być dodatkowe elementy strukturalne. Galektyny, na podstawie molekularnej architektury, zaliczamy do trzech podrodzin: galektyny prototypiczne (galektyny zawierające pojedyncze CRD, zdolne do dimeryzacji), tandemowe (galektyny zawierające dwa różne CRD na jednym łańcuchu polipeptydowym, również zdolne do oligomeryzacji) oraz chimeryczne (do tej rodziny należy galektyna-3, która oprócz CRD posiada długi nieustrukturyzowany koniec N).
W Zakładzie Biotechnologii Medycznej badamy funkcje galektyn zarówno na powierzchni komórki jak i w jej wnętrzu, głównie w kontekście przekazywania sygnałów przez receptory o aktywności kinaz tyrozynowych RTK i ich ligandów oraz endocytozy powierzchniowych receptorów. Badamy w jaki sposób galektyny odczytują kod cukrowy zapisany w strukturze glikoprotein do przekazywania sygnałów. Badamy również znaczenie specyficzności oraz multiwalentności galektyn, oraz ich zdolność do przejść fazowych ciecz-ciecz LLPS (z ang. Liquid-Liquid Phase Separation) dla ich funkcji.
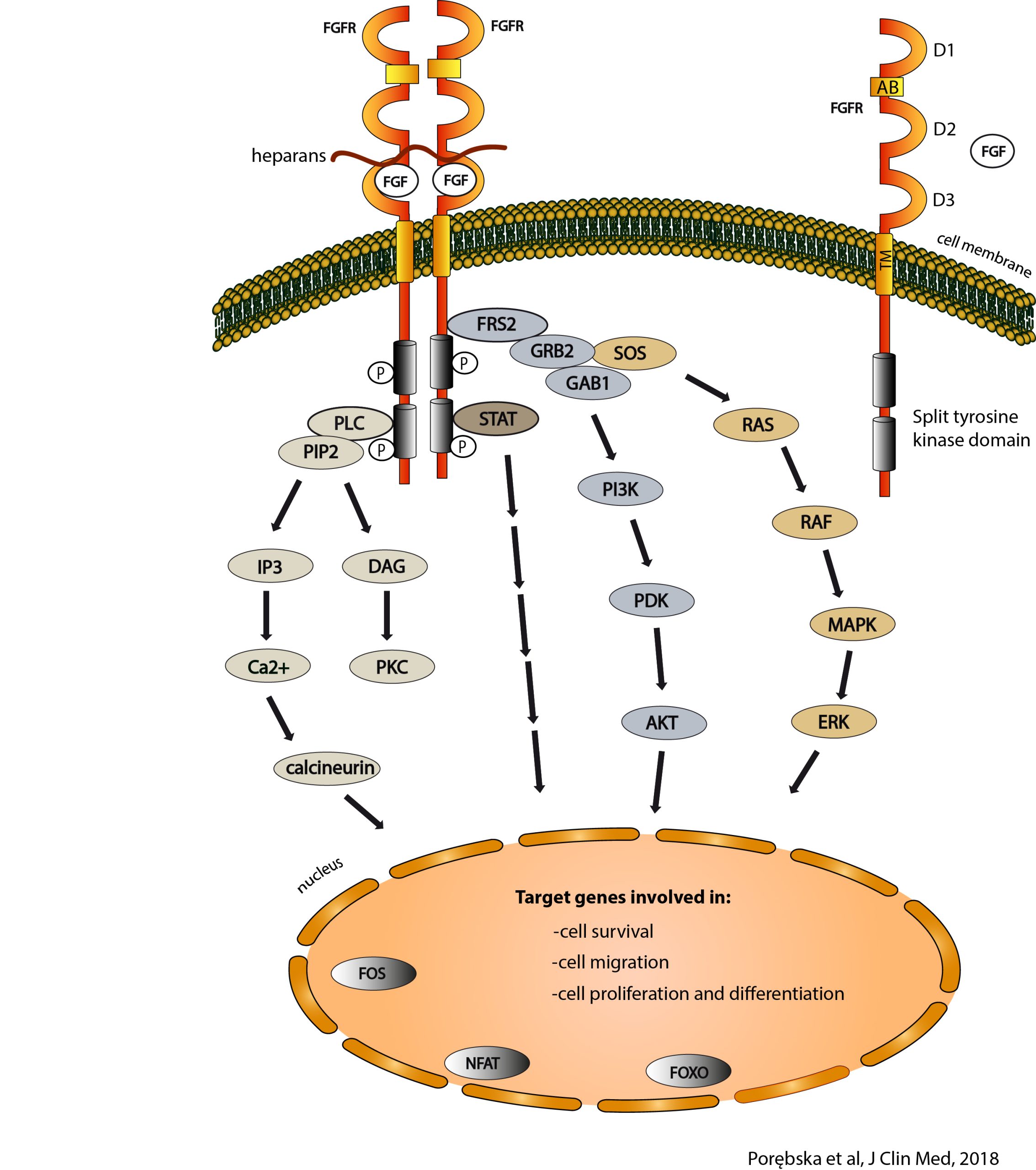
Fibroblastyczne czynniki wzrostu FGF (z ang. Fibroblast Growth Factors) i ich receptory FGFR (z ang. Fibroblast Growth Factor Receptors) stanowią huby sygnalizacyjne, które umożliwiają przekazywanie sygnałów z zewnątrz komórki do jej wnętrza. Zewnątrzkomórkowe czynniki wzrostu FGF rozpoznają zakotwiczone w błonie komórkowej receptory FGFR, wpływając na ich konformację i prowadząc do aktywacji ich wewnątrzkomórkowych domen o aktywności kinaz tyrozynowych (TK). Prowadzi to z kolei do inicjacji wewnątrzkomórkowych kaskad przekazywania sygnałów, które regulują podstawowe procesy komórkowe, takie jak apoptoza, ruchliwość, metabolizm czy podział. System FGF/FGFR jest niezbędny do prawidłowego rozwoju organizmu ludzkiego, a jego defekty związane są z szeregiem chorób, w tym chorób nowotworowych. W około 10% nowotworów obserwowane są zmiany w FGF/FGFR, które zazwyczaj prowadzą do niekontrolowanej, zbyt silnej aktywacji ścieżek sygnałowych zależnych od FGF/FGFR, ułatwiając nowotworzenie.
W naszych badaniach koncentrujemy się na identyfikacji białek przestrzeni zewnątrzkomórkowej oraz błony plazmatycznej, które mogą regulować przekazywanie sygnałów przez system FGF/FGFR. Badamy też oligomeryzację FGFR oraz wpływ różnych stanów oligomerycznych FGFR na specyfikę przekazywania sygnałów.
W naszych badaniach chcemy ustalić, czy połączenie antagonisty receptora kwasu retinowego (RAR) γ i agonisty receptora witaminy D (VDR) mogą być zastosowane jako terapia indukująca różnicowanie u pacjentów z ostrymi białaczkami szpikowymi (AML). Określimy powinowactwo antagonisty RARγ, agonisty VDR oraz nowych związków hybrydowych do rekombinowanego RARγ i rekombinowanego VDR. Zbadamy, w jaki sposób związki te aktywują transkrypcję genów zależnych od VDR i jak blokują transkrypcję genów zależnych od RARγ. Będziemy badać działanie powyższych związków na liniach komórkowych AML i blastach ze szpiku kostnego pacjentów z AML. Naszym celem będzie też określenie globalnego transkryptomu w liniach komórkowych i blastach AML eksponowanych na działanie antagonisty RARγ ± agonisty VDR.
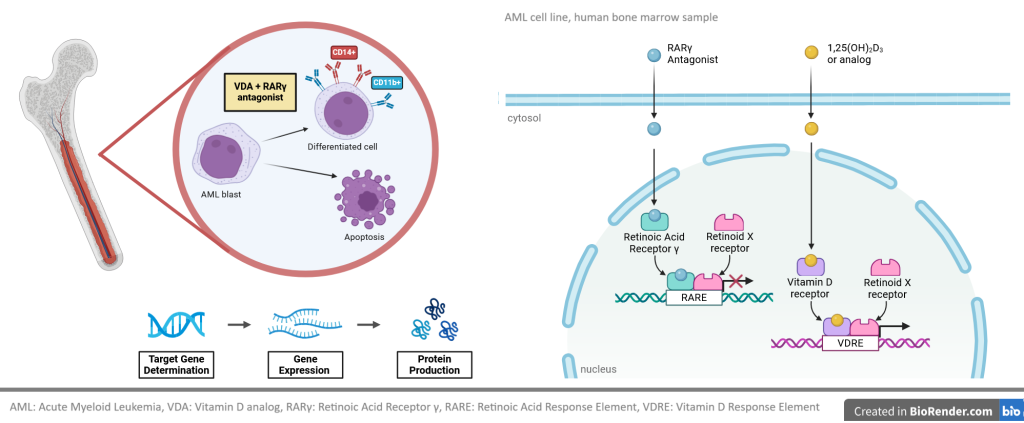
W naszych badaniach staramy się określić rolę receptorów kwasu retinowego (RAR) α i γ w rozwoju ostrej białaczki szpikowej (AML). Badamy względną ekspresję RARA i RARG w leukocytach szpiku kostnego osób zdrowych oraz w blastach pacjentów ze stanami przedbiałaczkowymi i białaczkami. Naszym celem jest przygotowanie modeli linii komórkowych AML z nadekspresją RARG w celu ustalenia, czy wpływa to na ich złośliwy potencjał. Będziemy też testować aktywność antagonisty RARγ przeciwko powyższym liniom komórkowym AML i przeciwko blastom szpiku kostnego pacjentów.
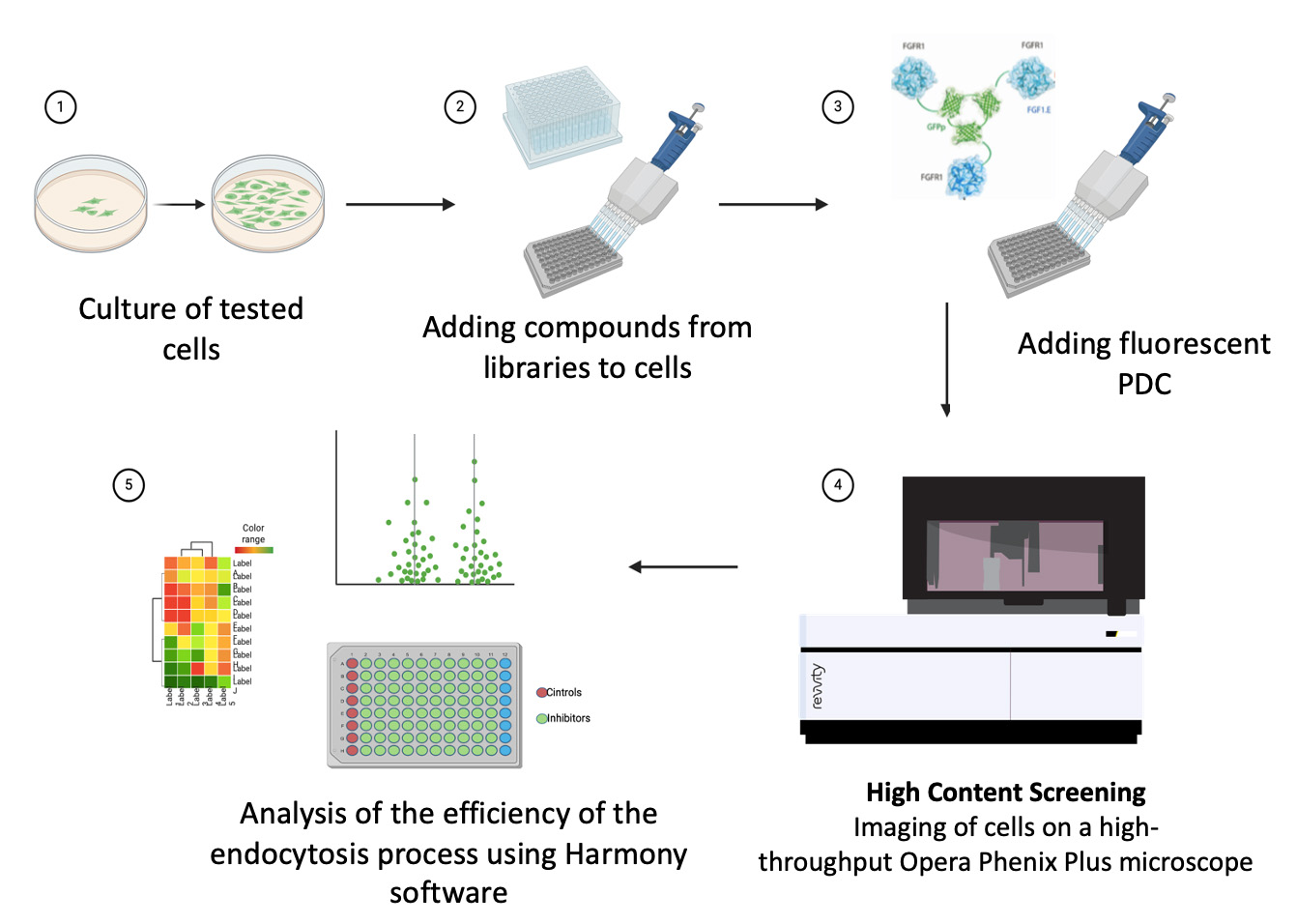
Endocytoza jest zbiorem szeregu molekularnych ścieżek, które używając różnych mechanizmów, umożliwiają komórce pobór substancji z jej powierzchni oraz z jej otoczenia. Endocytoza wydaje się być pod ścisłą kontrolą komórkowych szlaków sygnałowych, jednak powiązania pomiędzy tymi skomplikowanymi procesami są ciągle niejasne.
W Zakładzie Biotechnologii Medycznej używamy techniki obrazowania wystkoprzepustowego HCS (z ang. High Content Screening) oraz duże, reprezentatywne biblioteki związków (np. bibliotekę inhibitorów kinaz zawierająca niemal 2000 związków) w celu identyfikacji specyficznych ścieżek sygnałowych regulujących badany proces komórkowy, głównie endocytozę. Uzyskana wiedza podstawowa, poza kluczowym znaczeniem dla zrozumienia mechanizmów komórkowych, pozawala nam na modulację dostarczania leków cytotoksycznych w przeciwnowotworowym podejściu celowanym typu PDC (z ang. Protein Drug Conjugates).
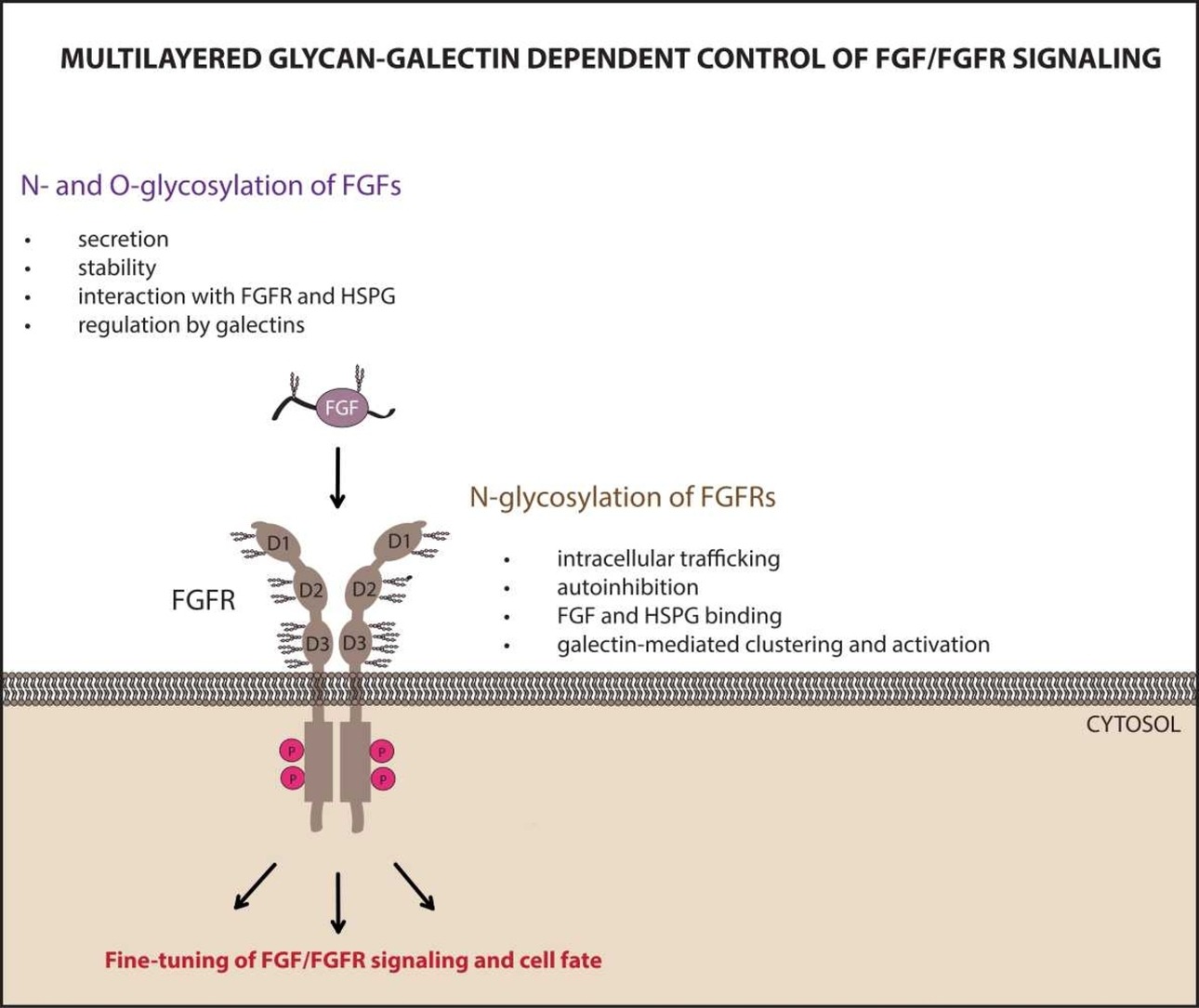
Zarówno receptory FGFR jaki i znacząca większość białek FGF jest modyfikowana poprzez dołączenie złożonych struktur cukrowych do łańcuchów polipeptydowych. W przypadku receptorów FGFR znacząca część ich zewnątrzkomórkowego regionu jest osłonięta przez N-glikany. W przypadku białek FGF mamy do czynienia z N- i O-glikozylacją zazwyczaj w jednej lub dwóch pozycjach; są to typowo nieustrukturyzowane regiony białek FGF, które mogą stanowić o unikalności białek FGF. Pomimo pojedynczych doniesień literaturowych sugerujących istotną rolę glikozylacji dla działania systemu FGF/FGFR, dokładne znaczenie tych modyfikacji jest nieznane.
W Zakładzie Biotechnologii Medycznej badamy modyfikacje potranslacyjne FGF i FGFR, koncentrując się na N-glikozylacji tych białek. W naszych pracach określamy znaczenie N-glikozylacji FGF/FGFR dla oddziaływań międzycząsteczkowych, stabilności, aktywacji i komórkowego transportu tych białek. Badamy też rolę glikozylacji FGF/FGFR jako „glikokodu” na powierzchni komórki odczytywanego przez lektyny z grupy galektyn.
Przy prawie 20 milionach nowych przypadków rocznie nowotwór stanowi jedno z najważniejszych wyzwań dla systemów zdrowia publicznego. W przeciwieństwie do tradycyjnej chemioterapii, ukierunkowane strategie przeciwnowotworowe wykorzystują zaawansowane terapie w celu precyzyjnej identyfikacji i celowania w komórki nowotworowe, ograniczając wpływ leków na zdrowe komórki i tym samym minimalizując niepożądane skutki uboczne terapii. Konjugaty białek z lekami lekowe PDC (z ang. Protein Drug Conjugates) to szybko rosnąca grupa ukierunkowanych terapii, składająca się z białkowego czynnika rozpoznającego receptor specyficzny dla komórek nowotworowych, kowalencyjnie sprzężonego z bardzo silnym lekiem cytotoksycznym. Kilka PDC, głównie w formie koniugatów przeciwciało-lek ADC (z ang. Antibody Drug Conjugates), które wykorzystują przeciwciała monoklonalne jako cząsteczki rozpoznające raka, jest stosowanych w klinice, a wiele PDC jest obecnie w trakcie badań klinicznych.
Wysoce selektywna, silna i stabilna interakcja PDC z markerem nowotworowym, w połączeniu z wydajną, szybką endocytozą kompleksu receptor/PDC i jego późniejszym skutecznym dostarczeniem do lizosomów, ma kluczowe znaczenie dla skuteczności ukierunkowanej terapii nowotworowej z PDC. Jednak biwalentna architektura monoklonalnych przeciwciał, o które oparte są współczesne PDC nie jest optymalna.
W Zakładzie Biotechnologii Medycznej opracowujemy multiwalentne (zdolne do wiązania jednocześnie wielu receptorów onkogennych) PDC, które charakteryzują się zwiększoną precyzją i wydajnością dostarczania leków do komórek nowotworowych. Konstruujemy multiwalentne PDC o różnej architekturze, sposobie miejscowo-specyficznego dostarczania leku, specyficzności oraz różnych dodatkowych cechach (np. stabilna fluorescencja). Dzięki silniejszemu i bardziej stabilnemu wiązaniu opracowane przez nas multiwalentne PDC są zdolne do sieciowania receptorów onkogennych na powierzchni komórek nowotworowych, prowadząc do jednoczesnej indukcji szeregu ścieżek endocytarnych, co zapewnia znacząco lepszy wychwyt leku oraz wydajne kierowanie do lizosomów celem uwolnienia toksycznego leku we wnętrzu komórki nowotworowej, powodując jej śmierć.
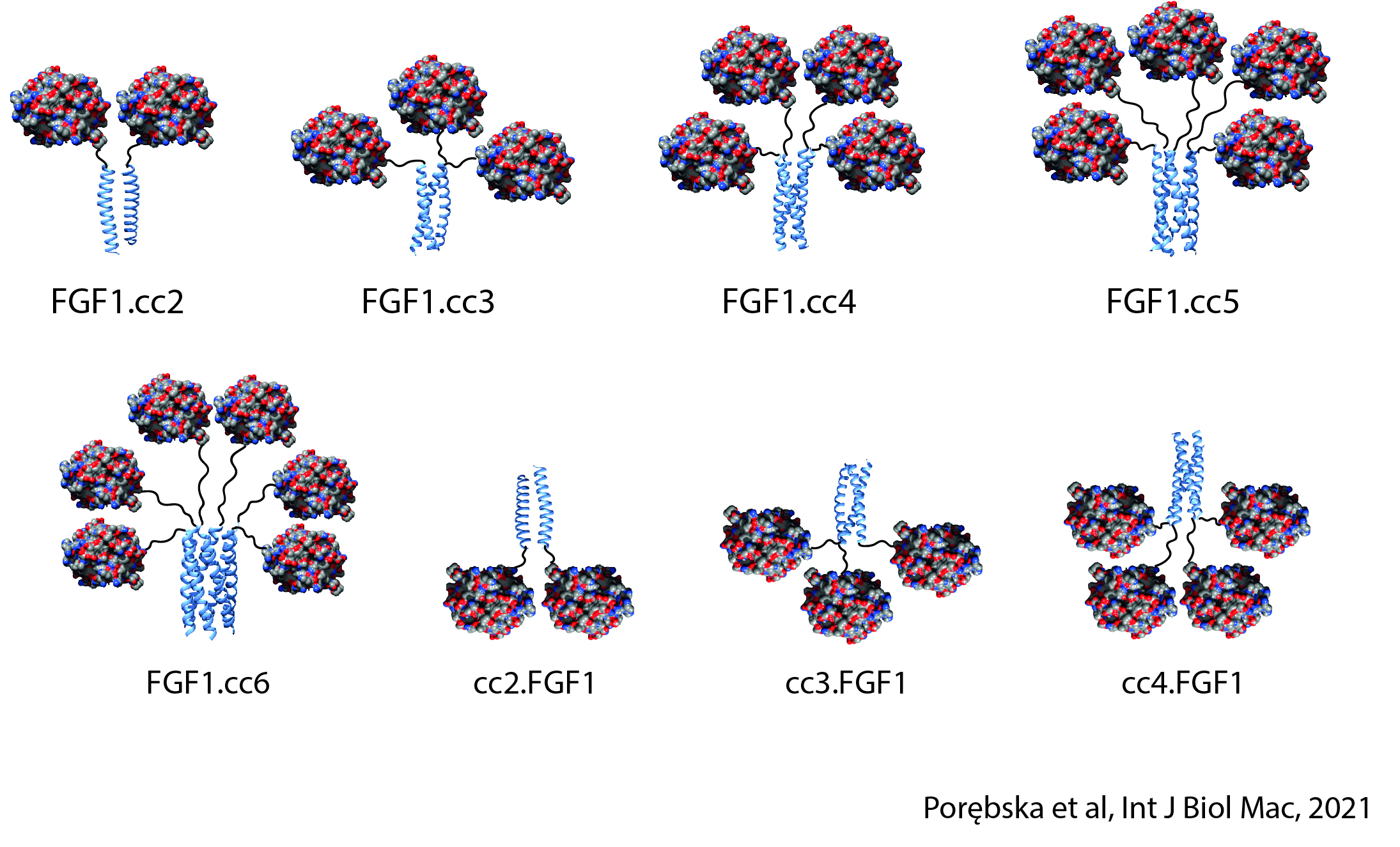
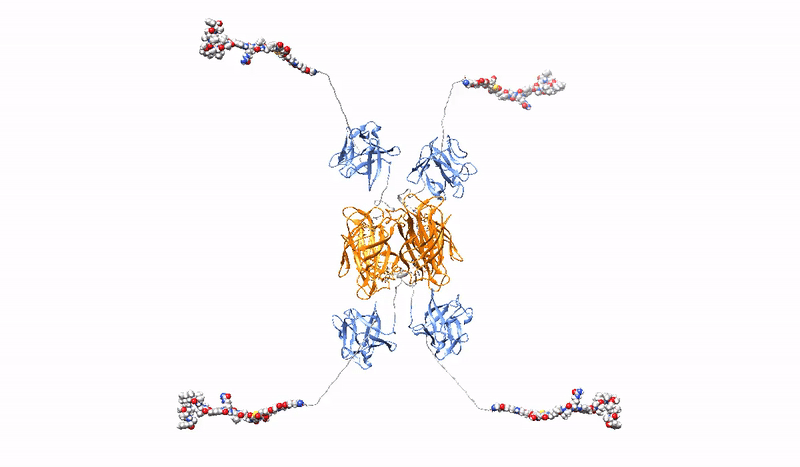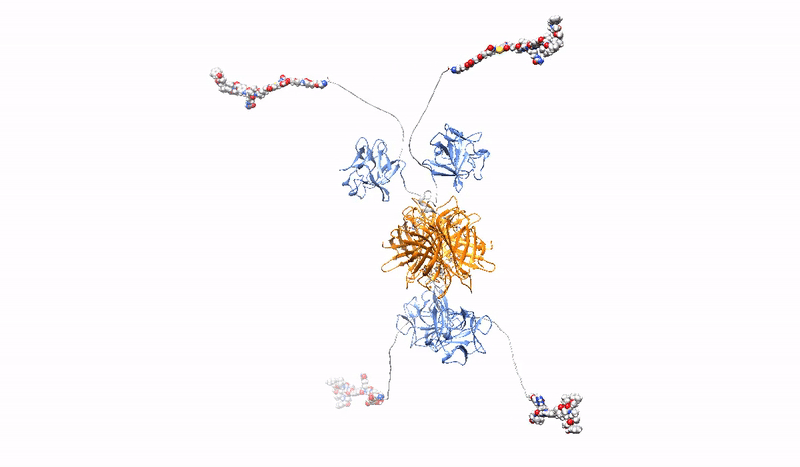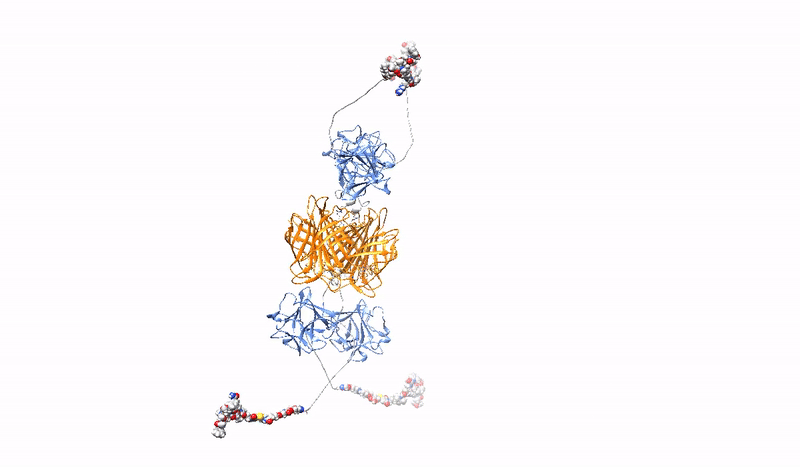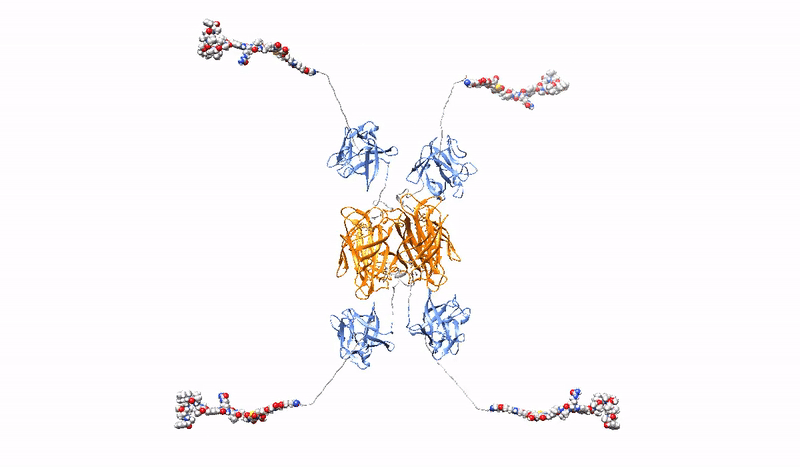
Siła i specyficzność sygnałów przekazywanych przez receptory powierzchni komórki mogą decydować o końcowym efekcie sygnałów na zachowanie komórki (np. decydować o przełączeniu ze stanu stacjonarnego do podziału). W Zakładzie Biotechnologii Medycznej testujemy, czy siła i specyficzność sygnałów przekazywanych przez receptory o aktywności kinazy tyrozynowej RTK zależą od stanu oligomerycznego receptorów. W Zakładzie Biotechnologii Medycznej projektujemy i przygotowujemy warianty oligomeryczne i mutacyjne galektyn oraz czynników wzrostu, które charakteryzują się zmienionymi właściwościami w stosunku do wyjściowych białek, np. zwiększonym powinowactwem do receptorów, zdolnością do sieciowania receptorów, zdolnością do modulacji endocytozy receptorów, zmienioną specyficznością czy polepszoną stabilnością. Uzyskane białka mogą posłużyć jako nośniki leków, modulatory metabolizmu czy czynniki stymulujące gojenie ran.
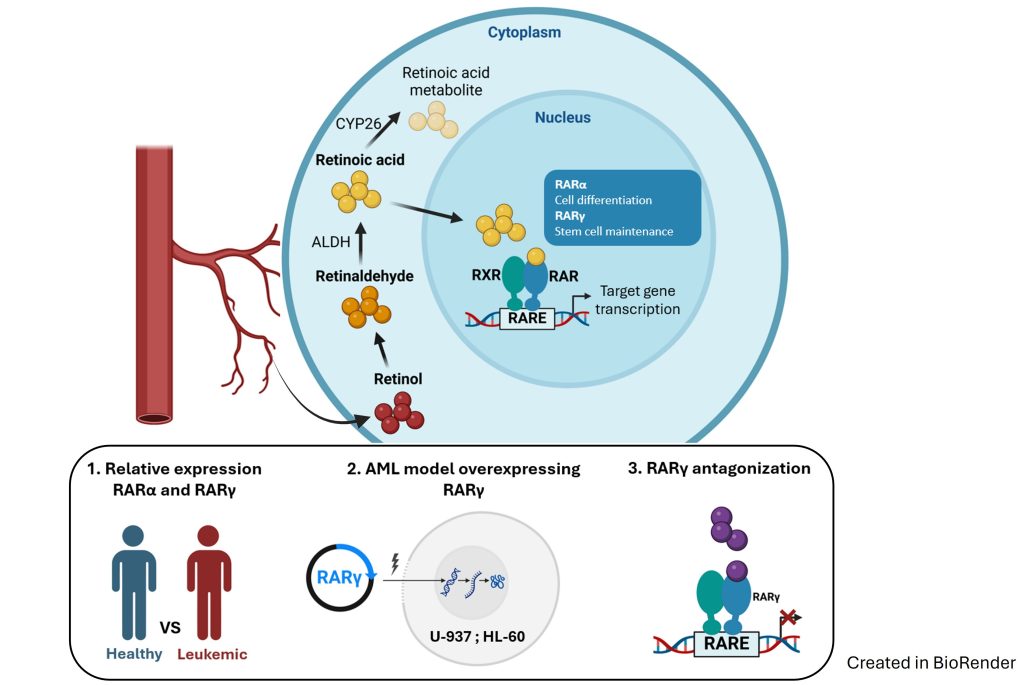
Receptor witaminy D (VDR) jest obecny i aktywny w wielu komórkach krwi, a prawidłowy poziom witaminy D jest niezbędny do prawidłowego funkcjonowania układu odpornościowego. Aktywny metabolit witaminy D, 1,25-dihydroksywitamina D (1,25D), wspomaga różnicowanie monocytów i wrodzoną odporność. 1,25D i jej analogi są zdolne do indukowania różnicowania i hamowania proliferacji w tych komórkach ostrych białaczek szpikowych (AML), które mają wystarczający poziom białka VDR.
Nasze badania wykazały, że nieprawidłowa transdukcja sygnału z konstytutywnie aktywnego białka fuzyjnego FOP2-FGFR1 jest odpowiedzialna za obniżenie ekspresji genu VDR w komórkach AML, co skutkuje opornością na różnicowanie indukowane przez 1,25D. Z drugiej strony, zbyt wiele receptorów FGF typu dzikiego na komórkach białaczkowych uwrażliwia je na 1,25D. Obecnie badamy, które wewnątrzkomórkowe szlaki sygnałowe można wykorzystać w terapii polegającej na indukcji różnicowania komórek AML.
Komórki utrzymują funkcjonalny proteom poprzez precyzyjne zrównoważenie zawartości, stężenia, konformacji i subkomórkowej lokalizacji białek. Wymaga to skoordynowanej interakcji między wyrafinowanymi komórkowymi maszynami molekularnymi, które wspomagają białka już od momentu ich syntezy do ostatnich momentów życia białek, postrzeganych jako utrata funkcji i późniejsza degradacja. Niepowodzenie w utrzymaniu homeostazy białek ma dramatyczne konsekwencje dla komórek i może ostatecznie prowadzić do stanów patofizjologicznych komórek lub ich śmierci. Ponieważ dysregulowane białka stanowią krytyczne czynniki napędowe większości chorób u ludzi, w tym nowotworów, stanowią one cele molekularne dla różnych interwencji terapeutycznych.
Chociaż zidentyfikowano ponad 4000 białek powiązanych z chorobami u ludzi, do tej pory tylko około 10% z nich zostało pomyślnie wykorzystanych w terapiach. Dlatego konieczne jest opracowanie nowych strategii, które umożliwią celowaną inaktywację licznych białek chorobotwórczych, które są poza zasięgiem obecnych metod. Około dwadzieścia lat temu opracowano koncepcję ukierunkowanej degradacji białek TPD (z ang. Targeted Protein Degradation). TPD angażuje naturalne mechanizmy proteolityczne komórek (głównie proteasomy lub lizosomy) aby specyficznie usuwać z komórki białka związane z chorobą, trafiając w białka, które do tej pory były poza zasięgiem konwencjonalnych metod opracowywania leków.
W Zakładzie Biotechnologii Medycznej opracowujemy nowe metody ukierunkowanej inaktywacji białek w komórce, które w odróżnieniu od obecnych strategii TPD nie bazują na autofagii oraz degradacji proteasomalnej.
