
Projekty badawcze prowadzone w Zakładzie Biotechnologii Medycznej


PROT-TOWING: opracowanie innowacyjnej technologii molekularnego holowania do selektywnej inaktywacji chorobotwórczych białek
Cel projektu:
Rozregulowane białka chorobotwórcze POI (ang. Protein of Interest) stanowią czynniki wywołujące wiele chorób u ludzi i stanowią cele molekularne dla interwencji terapeutycznych. Tradycyjnie do hamowania chorobotwórczych POI stosuje się niskocząsteczkowe inhibitory enzymów lub blokery kanałów jonowych, które stanowią większość obecnie stosowanych leków. Pomimo niewątpliwego sukcesu opracowanych konwencjonalnie leków, podejście to okazało się skuteczne jedynie dla około 10% białek chorobotwórczych, a większość chorobotwórczych POI (np. czynniki transkrypcyjne, białka budulcowe) jest obecnie poza naszym zasięgiem.
Celem projektu PROT-TOWING jest opracowanie innowacyjnej technologii pozwalającej na ukierunkowaną inaktywację chorobotwórczych białek w komórce, w tym celów molekularnych niedostępnych dla obecnych podejść terapeutycznych, co może umożliwić w przyszłości rozwój strategii terapeutycznych na do tej pory nieuleczalne choroby.
W ramach projektu przeprowadzone zostaną eksperymenty z pogranicza chemii organicznej, biofizyki, biochemii, biologii molekularnej i komórkowej, które pozwolą na opracowanie wysoce innowacyjnej technologii ukierunkowanej inaktywacji białek. Do realizacji projektu zakupiona zostanie zaawansowana aparatura badawcza w postaci interferometru biowarstwowego (BLI) oraz zamrażarka niskotemperaturowa.
Rezultatem projektu będzie nowa technologia umożliwiająca selektywną inaktywację białek cytozolowych PROT-TOWING.
Grupami docelowymi projektu są firmy biotechnologiczne, chemiczne lub farmaceutyczne, a w dalszej perspektywie pacjenci (w przypadku opracowania w przyszłości leków opartych na technologii PROT-TOWING). Projekt doprowadzi też do rozwoju nowych kadr badawczych.
Projekt realizowany będzie we współpracy z krajowym partnerem gospodarczym – firmą Captor Therapeutics S.A. oraz z zagranicznym partnerem naukowym – zespołem prof. Idy van der Klei z Uniwersytetu w Groningen, w Holandii.
Projekt finansowany jest ze środków Unii Europejskiej.
PI (główny wykonawca): prof. dr hab. Łukasz Opaliński
Wartość projektu: 3 878 448,40 zł
Wysokość wkładu Funduszy Europejskich: 3 878 448,40 zł
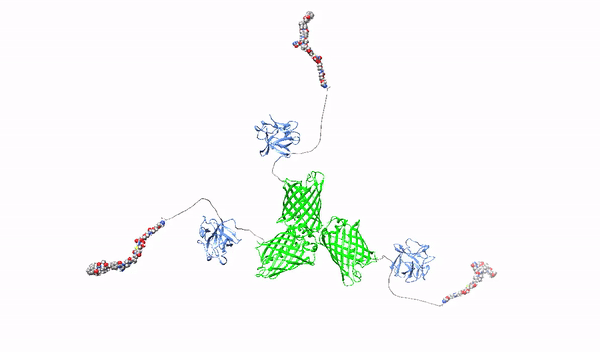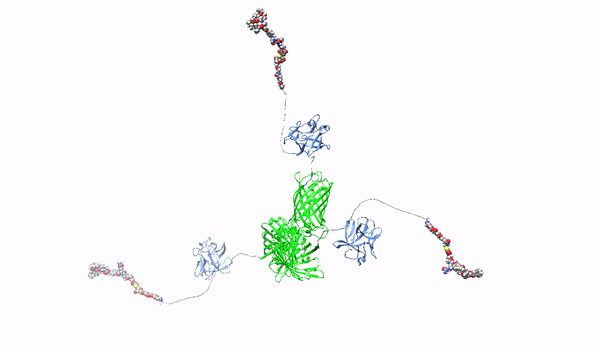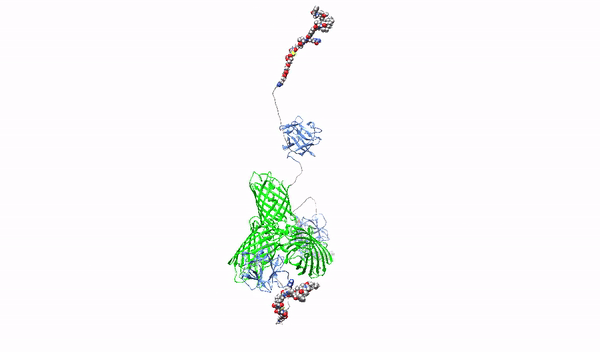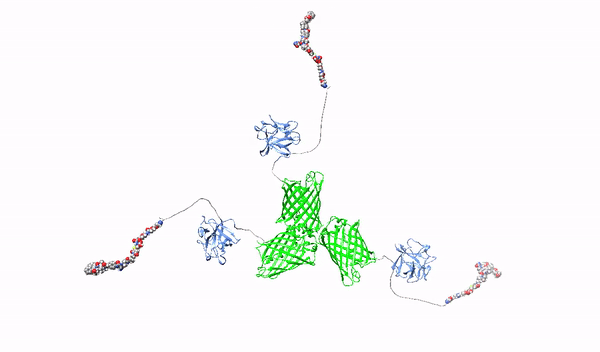
Celowanie w powierzchniowe proteoglikany multimerycznymi ligandami o wysokim powinowactwie oraz ich cytotoksycznymi koniugatami-w stronę terapii precyzyjnej raka trzustki
Projekt badawczy NCN Nr 2021/43/B/NZ1/00245 (2022-2026); kierownik projektu: prof. dr hab. Łukasz Opaliński
Rak trzustki jest najbardziej śmiertelnym nowotworem (5-letnia przeżywalność po diagnozie wynosi jedynie 9%), a liczba diagnozowanych pacjentów ciągle wzrasta. Wysoka śmiertelność raka trzustki wynika z późnej diagnozy, z limitowanych możliwości chirurgicznej interwencji oraz z ograniczonej dostępności skutecznych terapeutyków. W związku z tym intensywnie poszukiwane są nowe metody diagnozy i możliwie nieinwazyjnego leczenia raka trzustki, w szczególności podejścia oparte o medycynę precyzyjną nowotworów, która charakteryzuje się znacznie mniejszymi efektami ubocznymi w porównaniu do terapii konwencjonalnych, np. chemioterapii.
Komórki nowotworowe charakteryzują się zwiększoną częstotliwością i niekontrolowanym charakterem podziałów, intensywną migracją oraz unikaniem śmierci. Proteoglikany (HSPGs) są białkami powierzchni komórki, które poprzez organizację działania czynników wzrostu oraz ich receptorów, umożliwiają komórkom nabywanie powyższych aktywności onkogennych. Co istotne, zaobserwowano znacznie zwiększone ilości HSPGs na powierzchni komórek raka trzustki w porównaniu do komórek zdrowych. Różnice w poziomie HSPGs pomiędzy zdrowymi i rakowymi komórkami trzustki oraz udział HSPGs w procesie nowotworzenia stanowi podstawę do projektowania przeciwnowotworowych terapii celowanych.
W ramach niniejszego projektu opracowane zostaną nowatorskie cząstki rozpoznające HSPGs z wysokim powinowactwem, które posłużą jako czynniki blokujące onkogenne działanie HSPGs oraz jako nośniki leków cytotoksycznych do selektywnego zabijania komórek raka trzustki. Jako wyjściową cząstkę użyjemy pierwszy czynnik wzrostu fibroblastów, FGF1, które posiada naturalną zdolność do oddziaływania z HSPGs. Białko FGF1 zostanie przeprogramowane w taki sposób, aby utraciło naturalną zdolność do stymulowania podziałów komórek oraz poprawione zostaną jego zdolności do wiązania HSPGs. Następnie, używając zmodyfikowany tak FGF1 oraz różne molekularne rusztowania, wytworzone zostaną oligomery FGF1, HMLAs, specyficznie i bardzo silnie oddziałujące z HSPGs. HMLAs, poprzez wiązanie HSPGs zablokują onkogenne działanie czynników wzrostu poprzez HSPGs oraz posłużą jako nośniki leków do selektywnego zabijania komórek nowotworu trzustki nadprodukujących HSPGs.
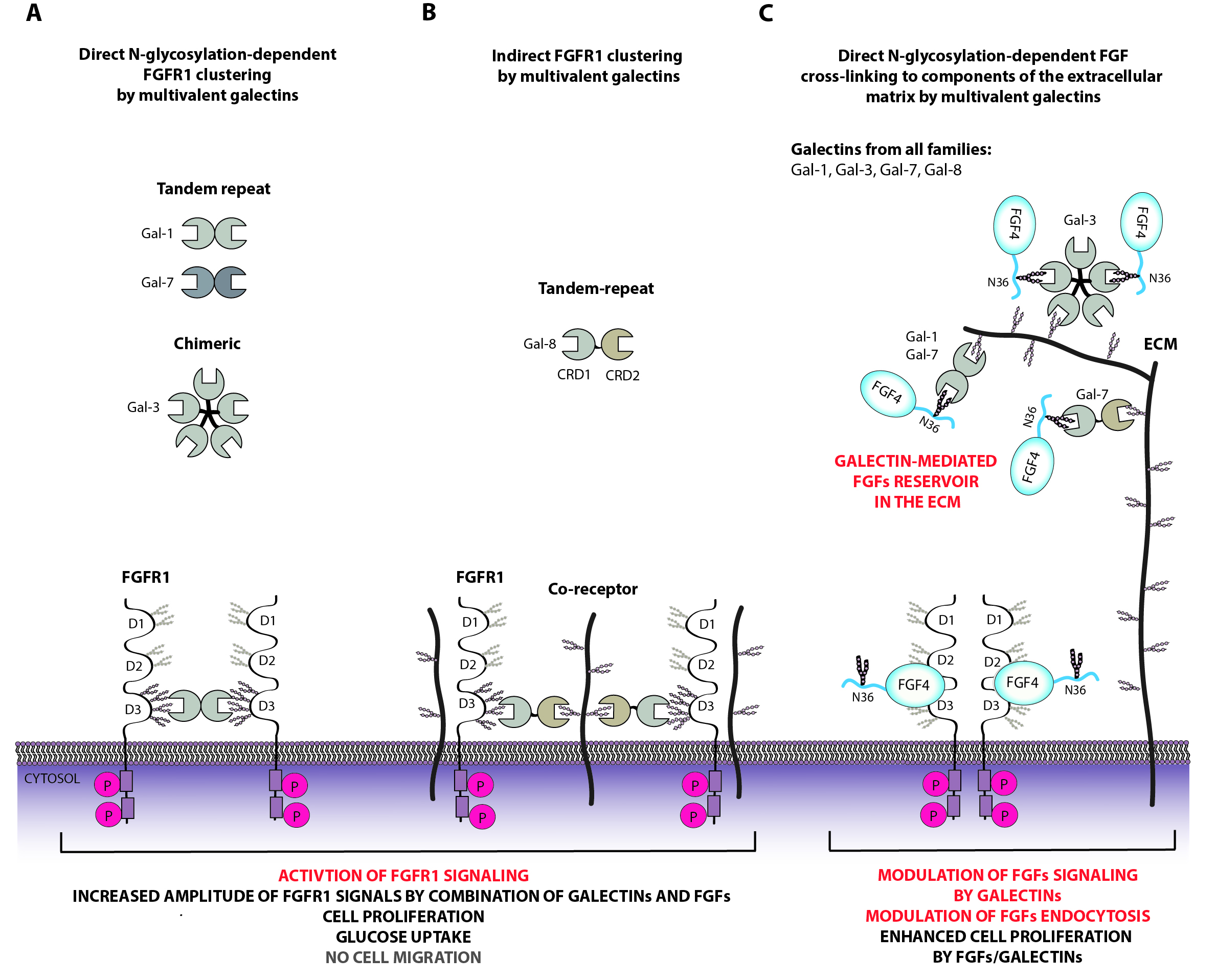
Regulacja receptorów czynników wzrostu fibroblastów przez zewnątrzkomórkowe galektyny
Projekt badawczy NCN Nr 2019/34/E/NZ3/00014 (2020-2025); kierownik projektu: prof. dr hab. Łukasz Opaliński
Funkcjonowanie komórek w znacznym stopniu regulowane jest przez białkowe receptory znajdujące się na powierzchni komórki, które przekazują sygnały z przestrzeni zewnątrzkomórkowej do wnętrza komórek. Szlaki przekazywania sygnału zależne o receptorów czynników wzrostu fibroblastów (FGFR) regulują metabolizm, komórki, różnicowanie komórek, ich podziały oraz ruchliwość. Białka FGFR są kluczowe dla prawidłowego rozwoju i funkcjonowania ludzkiego organizmu, a niekontrolowane zmiany w działaniu FGFR prowadzą do poważnych chorób metabolicznych oraz nowotworzenia. Ze względu na kluczową rolę, białka FGFR podlegają ścisłej i wielopoziomowej kontroli w komórce. W ostatnim czasie zidentyfikowaliśmy nowy mechanizm regulacji FGFR. Wykazaliśmy, że zewnątrzkomórkowe białka wiążące cukry: galektyna-1 oraz galektyna-3 oddziałują z resztami cukrowymi dołączonymi do białek FGFR, co wpływa na przekazywanie sygnałów przez FGFR oraz na funkcjonowanie komórek. Ludzka rodzina galektyn składa się z jedenastu białek, a ich rola w regulacji FGFR jest nieznana.
Nasza hipoteza badawcza zakłada, że przekazywanie sygnałów przez receptory FGFR oraz komórkowy transport FGFR podlega złożonej regulacji poprzez zewnątrzkomórkowe białka z rodziny galektyn. Głównym celem tego projektu jest poznanie roli wszystkich białek z rodziny galektyn w regulacji transportu komórkowego oraz funkcji receptorów FGFR. W ramach projektu ustalimy które galektyny oddziałują z FGFR oraz szczegółowo scharakteryzujemy te interakcje. Zbadamy czy i w jaki sposób galektyny wpływają na oddziaływanie receptorów FGFR ze swoimi białkami partnerskimi w komórce. Ustalimy rolę galektyn w regulacji przekazywania sygnałów przez FGFR oraz w komórkowym transporcie tych receptorów. W ostatniej fazie projektu zbadamy jak współzależność galektyn i FGFR wpływa na funkcjonowanie komórek.
Wyniki uzyskane podczas realizacji tego projektu charakteryzować się będą wysokim stopniem nowatorskości oraz dużym znaczeniem dla rozwoju dyscypliny naukowej. Zrozumienie jak białka z rodziny galektyn oraz receptory FGFR współdziałają w regulacji funkcjonowania komórki ma kluczowe znaczenie dla rozwoju biologii komórki oraz zrozumienia procesu nowotworzenia. Dodatkowo, uzyskane dane mogą umożliwić projektowanie nowych terapii przeciwko nowotworom oraz chorobom metabolicznym.
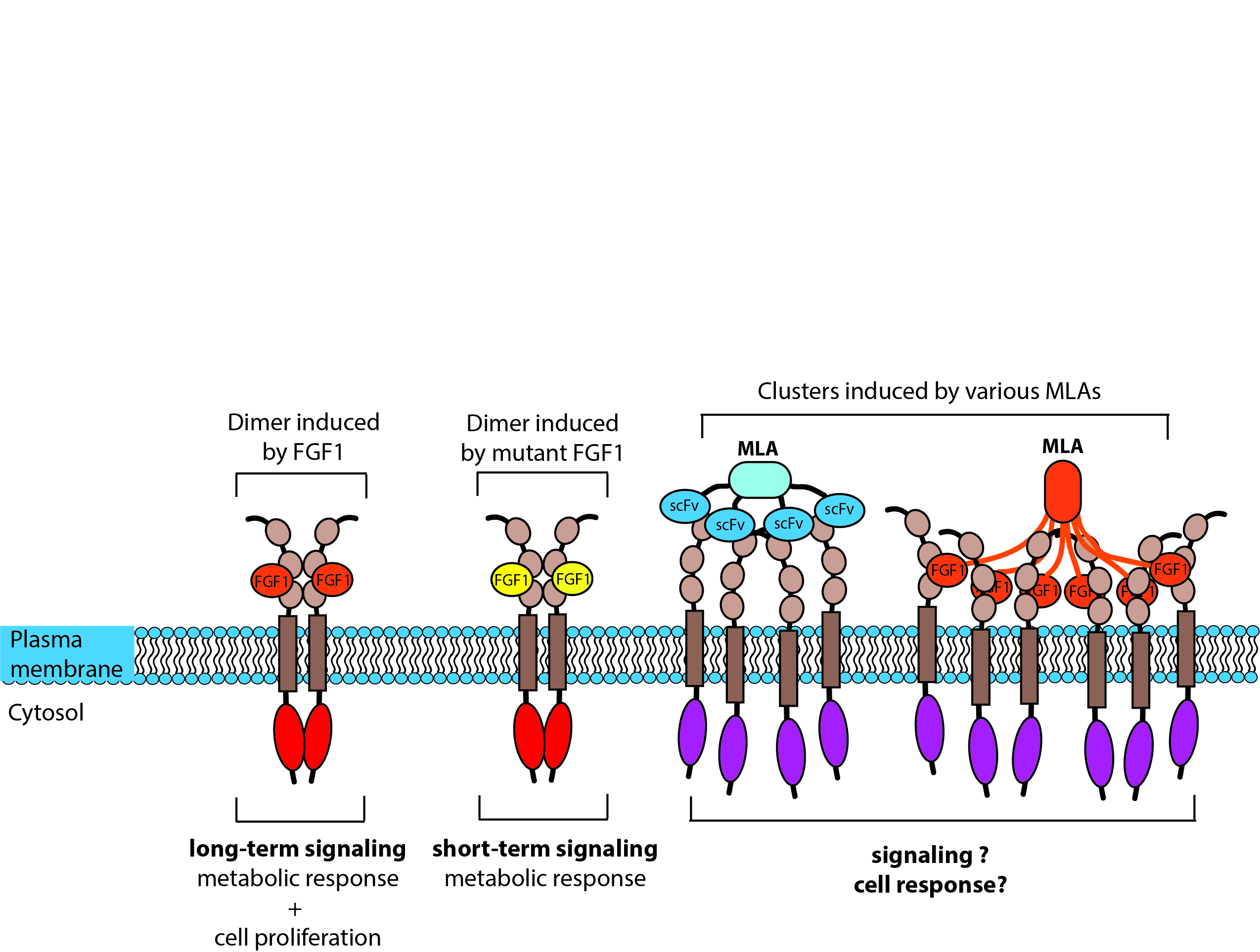
Kontrola przestrzennego ułożenia FGFR1 przez multimeryczne ligandy
Projekt badawczy Fundacji na Rzecz Nauki Polskiej FIRST TEAM Nr. POIR.04.04.00-00-43B2/17-00, kierownik: prof. dr hab. Łukasz Opaliński
Przestrzenną organizację białek błony plazmatycznej można osiągnąć albo poprzez mechanizmy wewnątrzkomórkowe (np. cytoszkielet, białka rusztowania), albo wykorzystując mechanizmy zewnętrzne, takie jak specyficzne ligandy. Istnieje kilka przykładów pokazujących, że zmiany w przestrzennej organizacji białek błonowych modulują ich funkcję. Do tej pory nie badano klastrowania FGFR1 i nie wiadomo, jak wymuszanie FGFR1 w oligomerycznych zespołach o różnej architekturze wpłynie na funkcję FGFR1 w przekazywaniu sygnału, przeżyciu komórek, migracji i transporcie receptorów. Ponieważ FGFR1 jest często nadprodukowany przez różne typy nowotworów, projektowanie multimerycznych ligandów, które wzmocnią internalizację FGFR1, może zapewnić nowe, wysoce skuteczne cząsteczki ukierunkowane na selektywną chemioterapię. Czas trwania sygnalizacji FGFR1 dyktuje wynik komórkowy (odpowiedź metaboliczna vs. mitogenna). Kontrola przestrzennego rozmieszczenia FGFR1 może skutkować modulacją odpowiedzi komórkowej, a zatem może być potencjalnie stosowana w leczeniu cukrzycy typu 2 lub regeneracji tkanek.
Ogólnym celem projektu jest wyjaśnienie, w jaki sposób grupowanie FGFR1 w oligomery o różnej architekturze na powierzchni komórki wpłynie na funkcję i transport komórkowy receptora. Stawiamy hipotezę, że indukcja różnych struktur oligomerycznych FGFR1 będzie modulować aktywność FGFR1 i jego internalizację.
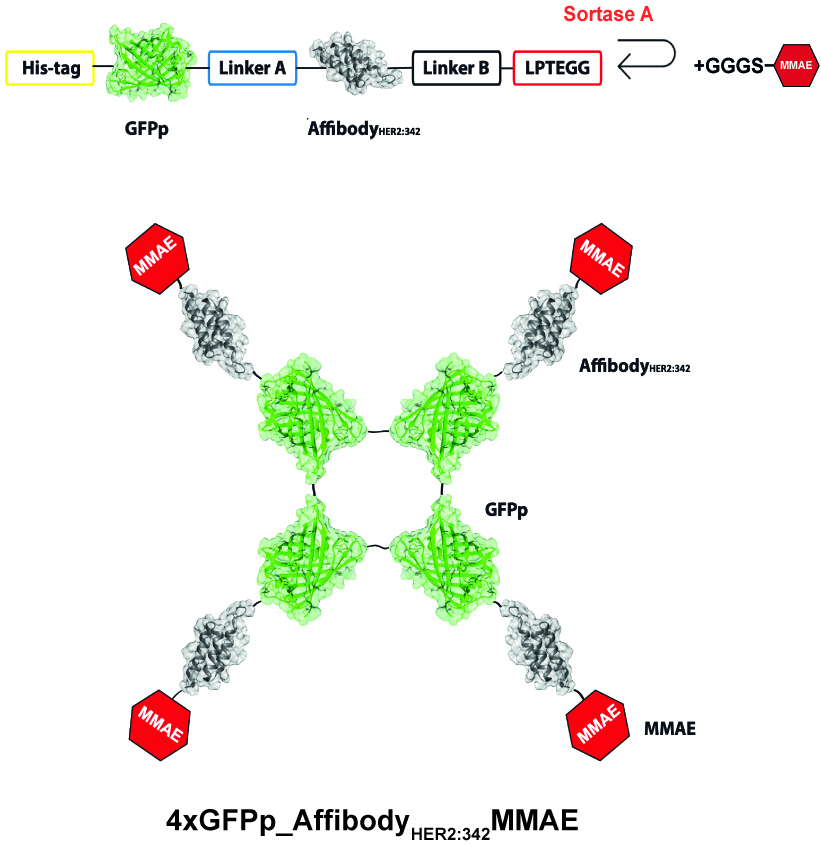
Wydajnie internalizujący fluorescencyjny oligomeryczny koniugat cytotoksyczny celujący w komórki raka piersi nadprodukujące HER2
Projekt badawczy NCN Nr 2022/45/N/NZ1/00088 (2022-2025); kierownik projektu: dr Natalia Porębska, opiekun naukowy: prof. dr hab. Łukasz Opaliński
Rak piersi jest najczęściej występującym nowotworem złośliwym u kobiet. Spośród wszystkich zdiagnozowanych przypadków około 20% stanowią guzy piersi charakteryzujące się nadmierną ekspresją receptora HER2 na powierzchni komórek. HER2 jest obecnie uważany za jeden z głównych czynników onkogennych w raku piersi. Do tej pory opracowano kilka strategii terapeutycznych, które niestety wykazują ograniczoną skuteczność. Dużym problemem jest wysoki koszt obecnych terapii, a także zdolność komórek nowotworowych do nabywania oporności na działanie leków. Opracowanie skutecznych terapii przeciwko HER2+ nowotworowi piesi jest wciąż dużym wyzwaniem dla współczesnej medycyny. Jednym z dotychczas opracowanych podejść terapeutycznych w leczeniu nowotworów piersi z nadekspresją HER2 są koniugaty przeciwciał z lekiem cytotoksycznym. Ważną cechą warunkującą skuteczność takich terapii jest specyficzne i wydajne wnikanie koniugatów cytotoksycznych za pośrednictwem receptora HER2 do wnętrza komórek rakowych, gdzie dochodzi do uwolnienia aktywnego leku. Niestety HER2 jest receptorem charakteryzującym się słabym wnikaniem do wnętrza komórek, dlatego pożądane są nowe strategię zwiększające wydajność tego procesu.
Na podstawie naszych wcześniejszych obserwacji stawiamy hipotezę, że sieciowanie receptora HER2 w większe kompleksy na powierzchni komórki za pośrednictwem oligomerycznych koniugatów cytotoksycznych zwiększy wnikanie do komórek rakowych leku poprzez HER2. Celem proponowanego projektu jest więc opracowanie nowego oligomerycznego koniugatu cytotoksycznego skutecznie eliminującego komórki rakowe wykazujące nadekspresję receptora HER2. Dodatkową zaletą zaprojektowanego koniugatu będzie jego fluorescencja, która umożliwi monitorowanie dystrybucji i działania leku cytotoksycznego.

Separacja faz ciecz-ciecz jako mechanizm biologicznej aktywności ludzkich galektyn
Projekt badawczy NCN Nr 2023/07/X/NZ1/01396 (2023-2024); kierownik projektu: dr Marta Kalka
Zjawisko separacji faz ciecz-ciecz (ang. liquid-liquid phase separation, LLPS) poprzez multiwalentne oddziaływania białko-białko, białko-RNA, RNA-RNA prowadzi do powstania bimolekularnych kondensatów, tzw. organelli bezbłonowych obecnych w cytoplazmie, jądrze oraz na błonie komórkowej. Powstałe kondensaty odgrywają istotną rolę w procesach komórkowych, m.in. w regulacji transkrypcji, organizacji chromatyny czy sygnalizacji wewnątrzkomórkowej. Najnowsze badania wskazują, że zjawisko LLPS może mieć szczególne znaczenie dla rozwoju chorób neurodegeneracyjnych i nowotworowych stanowiąc tym samym nowy cel terapeutyczny. Celem badania jest sprawdzenie zdolności ludzkich galektyn do tworzenia faz ciecz-ciecz.

Molekularne podstawy internalizacji przeciwciał skierowanych przeciwko receptorom czynnika wzrostu fibroblastów FGF
Projekt badawczy NCN Nr 2015/16/S/NZ3/00363 (2015-2018); kierownik projektu: prof. dr hab. Łukasz Opaliński
Celem tego projektu jest poznanie molekularnych podstaw selektywnej internalizacji przeciwciał skierowanych przeciwko receptorom FGF. Używając specyficznych inhibitorów endocytozy zidentyfikujemy białka oddziałujące z receptorem FGF na etapie formowania kompleksu endocytarnego. Używając biblioteki przeciwciał, które wiążą się do różnych zewnątrzkomórkowych regionów receptorów FGF, zbadamy czy wiązanie FGFR przez te przeciwciała wpływa na składanie kompleksu endocytarnego. W ramach tego projektu określimy również, czy zewnątrzkomórkowe regiony receptora FGF mogą regulować endocytozę kompleksu FGFR – przeciwciało oraz ustalimy, w jaki sposób FGFR przekazuje sygnał inicjujący endocytozę poprzez błonę komórkową. Stosując przeciwciała, które wiążą się z receptorami FGF z różnym powinowactwem określimy, czy internalizacja kompleksu przeciwciało – FGFR jest zależna od energii oddziaływania przeciwciało – FGFR. Zbadamy również, czy przeciwciała mogą same indukować endocytozę FGFR, czy też do internalizacji kompleksu przeciwciało – FGFR wymagane jest dodatkowo wiązanie czynnika wzrostu. W końcu zbadamy, czy rozmiar przeciwciała ma wpływ na wydajność, czy też mechanizm internalizacji kompleksu przeciwciało-FGFR.
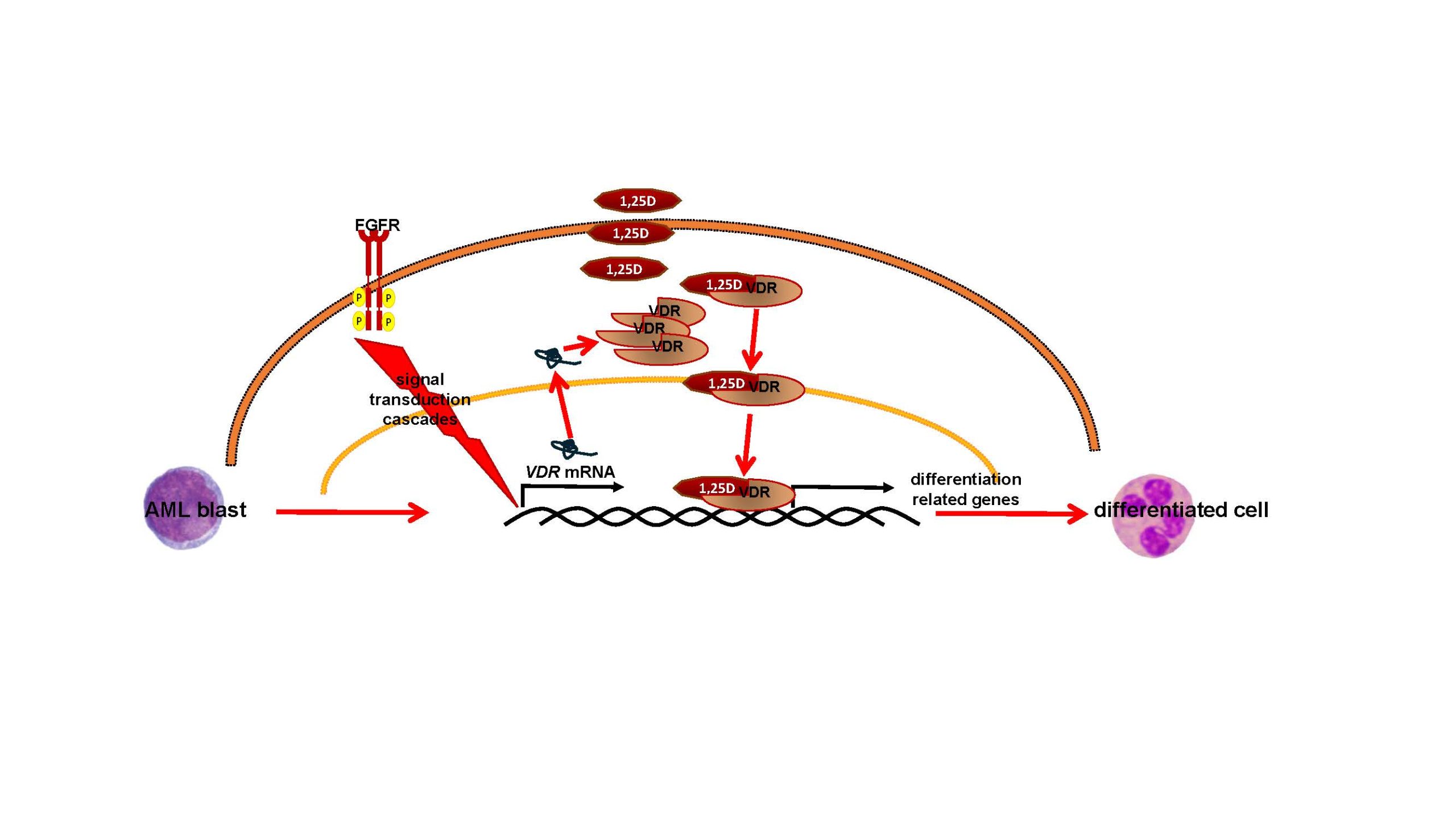
Badanie znaczenia receptorów fibroblastycznych czynników wzrostu oraz czynników transkrypcyjnych STAT w celowanej terapii ostrych białaczek szpikowych
Projekt badawczy NCN Nr 2022/47/O/NZ5/00288 (2023-2027); kierownik projektu: prof. dr hab. Ewa Marcinkowska
Fibroblastyczne czynniki wzrostu (FGF) oraz ich receptory są niezwykle ważne dla prawidłowego rozwoju embrionalnego oraz dla gojenia się ran. Jednakże mutacje w genach kodujących receptory FGF mogą być przyczyną rozwoju nowotworów, zarówno guzów litych, jak i białaczek. Niektóre z tych mutacji to tak zwane amplifikacje genu, które powodują, że komórki mają zbyt dużą liczbę receptorów na powierzchni. Nie jest jasne, jak często takie amplifikacje występują w białaczkach, ponieważ ten typ mutacji nie jest rutynowo diagnozowany u pacjentów z tymi chorobami. Niedawno nasz zespół odkrył, że zbyt duża ilość receptorów FGF na komórkach białaczkowych powoduje, że komórki te stają się bardziej wrażliwe na działanie aktywnej formy witaminy D, która nazywa się 1,25-dihydroksywitaminą D. Odkryliśmy też, że korzystne dla pacjentów może być zablokowanie czynników transkrypcyjnych o nazwie STAT, za pomocą inhibitora, fludarabiny.
Główną rolą witaminy D, która jest produkowana przez ludzki organizm z cholesterolu pod wpływem ekspozycji na światło słoneczne, jest regulowanie gospodarki wapniowo- fosforanowej, zapobieganie krzywicy oraz osteoporozie. W ostatnich latach udowodniono, że 1,25- dihydroksywitamina D ma też istotne znaczenie dla rozwoju komórek krwi i funkcjonowania układu odporności, a deficyt witaminy D sprzyja rozwojowi chorób autoimmunologicznych oraz niektórych nowotworów. Pod wpływem 1,25-dihydroksywitaminy D komórki niektórych białaczek zaczynają upodabniać się do prawidłowych komórek układu odporności. Dlatego chcielibyśmy się dowiedzieć, w jak wielu przypadkach białaczek występują amplifikacje genów kodujących receptory FGF i czy w przypadku białaczek z takimi mutacjami terapia za pomocą analogów 1,25-dihydroksywitaminy D oraz fludarabiny mogłaby poprawić kondycję pacjenta.
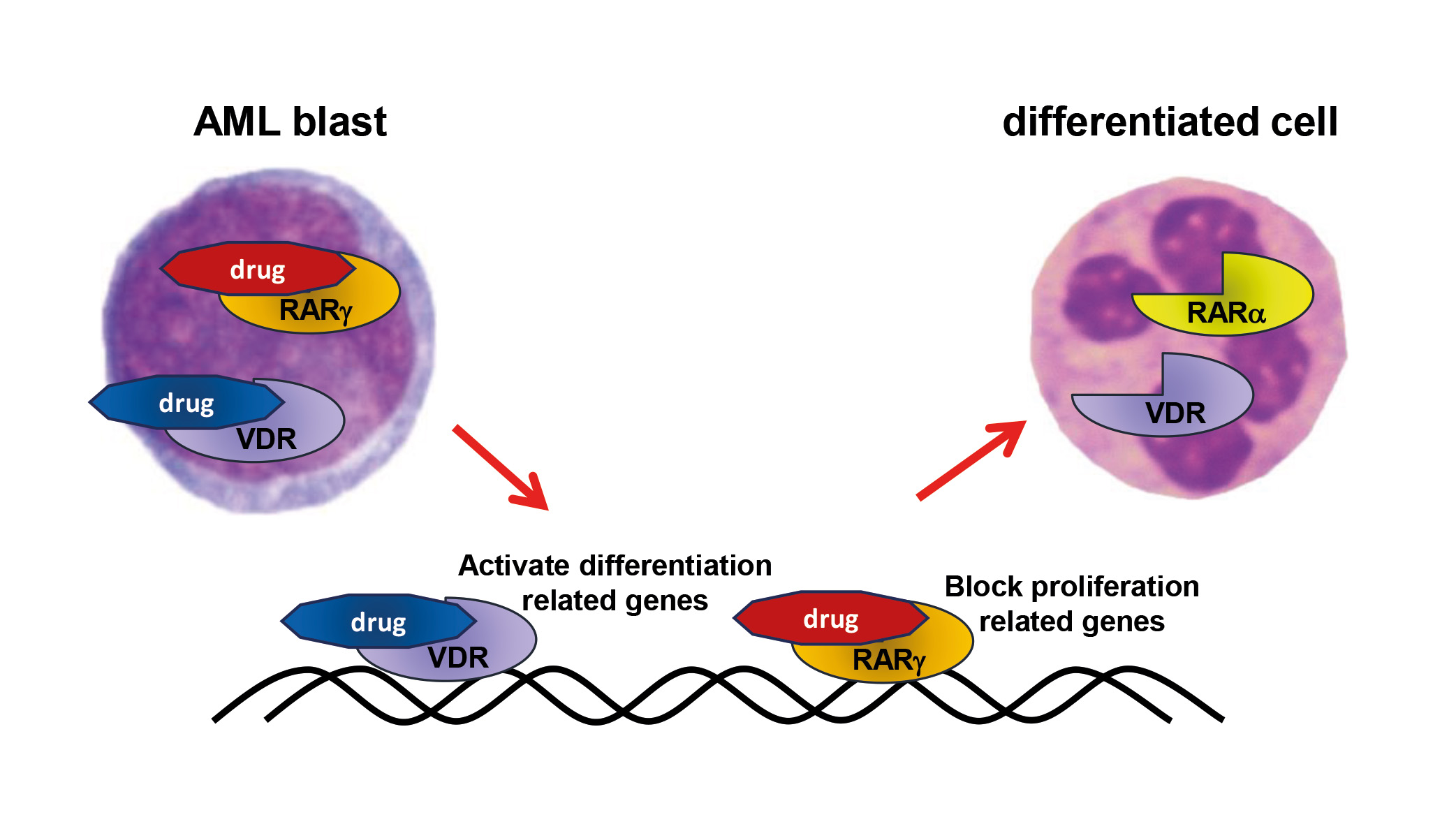
Innovative ligands for nuclear receptors to eradicate cancer relapse – eRaDicate
Projekt Marie Skłodowska-Curie Doctoral Networks (MSCDN); Call: HORIZON-MSCA-2022-DN-01-01, kierownik zadania: prof. dr hab. Ewa Marcinkowska
Celem międzynarodowego programu badań i rozwoju leków przeciwnowotworowych „eRaDicate” jest umożliwienie 11 młodym naukowcom rozwoju w badaniach nad nowotworami, przy jednoczesnym opracowaniu nowych terapii przeciwko nawrotom i przerzutom powodowanym przez komórki macierzyste raka. Receptory jądrowe, takie jak receptor kwasu retinowego (RAR) i receptor witaminy D (VDR), odgrywają ważną rolę w niektórych nowotworach i mogą stanowić skuteczne cele terapii przeciwnowotworowych. Aby zająć się priorytetem UE „Misja Nowotwory”, będziemy
1) testować aktywność przeciwnowotworową związków celujących w RAR i VDR;
2) projektować i syntetyzować związek hybrydowy o podwójnym działaniu działający jednocześnie jako antagonista RARγ i agonista VDR;
3) opracowywać strategie pre-formulacji dla naszych związków;
4) opracowywać nowatorską, opartą na głębokim uczeniu metodę analizy i diagnostyki raka.
Grupa z Uniwersytetu Wrocławskiego, która wchodzi w skład konsorcjum „eRaDicate” zajmuje się badaniem przeciw-białaczkowych aktywności nowych ligandów receptorów VDR i RARg, mechanizmów ich działania oraz roli RARg jako onkogenu w komórkach krwi.
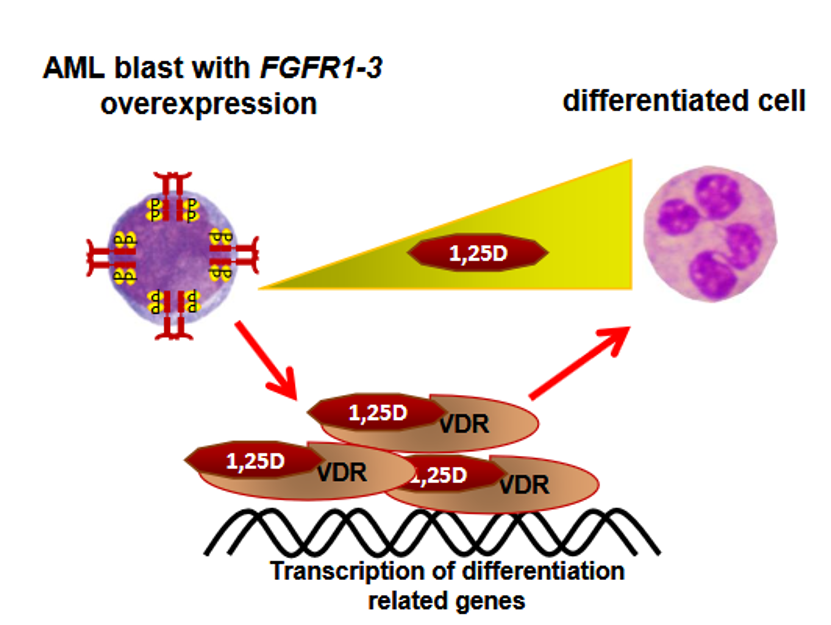
Współdziałanie szlaków sygnalizacji od receptorów fibroblastycznych czynników wzrostowych z receptorem dla witaminy D w procesie powstawania nowotworów krwi
Projekt badawczy NCN Nr Nr 2016/23/B/NZ5/00065 (2017-2021); kierownik projektu: prof. dr hab. Ewa Marcinkowska
Ostra białaczka szpikowa to choroba nowotworowa krwi, na którą chorują głównie osoby starsze. Nieleczona ma bardzo szybki i ciężki przebieg. Ponieważ jest to choroba komórek krwi, jej objawy związane są z upośledzeniem ich funkcji. Towarzyszą jej anemia, zaburzenia krzepnięcia i osłabienie odporności. U podstaw tej choroby są mutacje występujące w komórkach krwiotwórczych. Zostało zidentyfikowanych około 200 różnych mutacji, które występują u pacjentów z ostrą białaczką szpikową. Wśród tych mutacji są takie, które dotyczą receptorów komórkowych, wiążących czynniki wzrostu fibroblastów, nazwanych FGFR.
Leczenie większości podtypów ostrej białaczki szpikowej polega na agresywnej chemioterapii, a po wyeliminowaniu komórek nowotworowych, na przeprowadzeniu transplantacji komórek macierzystych krwiotworzenia. Obie procedury są często zbyt ciężkie dla pacjentów w starszym wieku, dlatego poszukuje się innych, łagodniejszych terapii, pozwalających albo wyeliminować chorobę, albo żyć z nią we względnym komforcie. Istnieje jeden podtyp ostrej białaczki szpikowej, ostra białaczka promielocytowa, dla której znaleziono tak zwaną terapię celowaną. Ta terapia, która za pomocą kwasu retinowego celuje bezpośrednio w zmutowane białko, jest skuteczna u prawie wszystkich pacjentów z tym podtypem.
W naszych badaniach skupiliśmy się na tych podtypach białaczki, w których mutacje dotyczą FGFR. Odkryliśmy, że komórki białaczkowe, które mają zbyt dużo FGFR na swojej powierzchni, można upodobnić (zróżnicować) do bardziej dojrzałych komórek układu odporności, stosując aktywną formę witaminy D oraz inhibitor jednego z białek sygnalizacyjnych, fludarabinę. Uważamy, że warto nasze obserwacje przetestować na modelach mysich ostrej białaczki szpikowej, po to aby zweryfikować, czy byłaby to dobra terapia celowana dla niektórych pacjentów z ostrą białaczką szpikową.

Współdziałanie receptora witaminy D (VDR) z receptorami kwasu retinowego (RAR) w procesie hematopoezy
Projekt badawczy NCN Nr Nr 2015/17/B/NZ4/02632 (2017-2021); kierownik projektu: prof. dr hab. Ewa Marcinkowska
Witamina D jest prohormonem, produkowanym w skórze z cholesterolu, pod wpływem ekspozycji na światło słoneczne. Może też być pozyskiwana w diecie lub suplementach diety. Witamina D jest aktywowana metabolicznie w wątrobie i w nerkach do aktywnego hormonu, którego głównym zadaniem w organizmie jest regulowanie gospodarki wapniowo-fosforanowej, zapobieganie krzywicy oraz osteoporozie. Poza tym, aktywna forma witaminy D reguluje działania układu odporności, jakkolwiek nie wszystkie mechanizmy tej regulacji zostały poznane. O tym, że zbyt niski poziom witaminy D w organizmie jest szkodliwy przekonują nie tylko przypadki chorych na krzywicę i osteoporozę, ale też badania wskazujące na cięższy przebieg Covid-19 u chorych z hipowitaminozą.
W naszym projekcie badaliśmy aktywność receptora dla aktywnej formy witaminy D w komórkach krwi na wszystkich etapach rozwoju, począwszy od komórek macierzystych krwiotworzenia, do dojrzałych komórek układu odporności u myszy oraz u ludzi. Nasze badania wykazały, że receptor jest bardziej aktywny w komórkach na wczesnych etapach krwiotworzenia, niż w komórkach dojrzałych. Okazało się, że gen kodujący receptor jest odmiennie regulowany u myszy i u ludzi. W komórkach mysich gen ten podlega autoregulacji pod wpływem aktywnej formy witaminy D, podczas gdy w komórkach ludzkich taka regulacja nie zachodzi. W ludzkich komórkach krwi gen kodujący receptor witaminy D jest regulowany pod wpływem aktywnego metabolitu witaminy A, podczas gdy taka regulacja nie występuje w komórkach mysich. Ponadto, struktura ludzkiego genu jest znacznie bardziej złożona, niż genu mysiego.
Decision-making within cells and differentiation entity therapies
Projekt MC-ITN (Marie Curie-Initial Training Networks); Call: FP7-PEOPLE-2012-ITN (2013-2017), kierownik zadania: prof. dr hab. Ewa Marcinkowska
Nadrzędnymi celami projektu DECIDE było: 1) lepsze zrozumienie procesu hematopoezy oraz 2) wytworzenie nowych analogów 1,25-dihydroksywitaminy D (1,25D) (zwanych vitamin D analogues; VDA), które mają zmniejszone działanie wapniowe i mogłyby mieć zastosowanie w terapiach przeciwnowotworowych.
1) Nasz punkt widzenia na hematopoezę odszedł od ścisłego schematu hierarchicznego w stronę bardziej plastycznego wzorca zachowania komórek progenitorowych hematopoezy (haematopoietic progenitor cells; HPC). Opcje ujawnione w przypadku HPC w testach in vitro można postrzegać jako opcje ukryte, a komórki macierzyste hematopoezy (haematopoietic stem cells; HSC) można postrzegać jako mniej plastyczne. Jednakże ważnym zastrzeżeniem jest to, że często bada się hematopoezę w stanie stacjonarnym, a ukryte opcje mogą okazać się ważne, gdy system krwiotworzenia jest obciążony i istnieje zwiększone zapotrzebowanie na określony typ komórek. Dalszych badań wymaga określenie, w jakim zakresie cytokiny krwiotwórcze prezentowane przez komórki macierzyste mezenchymalne i sekretom tych komórek odgrywają rolę podczas hematopoezy.
2) Prace w ramach tego projektu doprowadziły do syntezy nowych VDA, które mają znacznie zmniejszone działanie wapniowe i są potencjalnymi lekami przeciwnowotworowymi. Jest to ważne, ponieważ długoterminowym ograniczeniem stosowania 1,25D w terapii przeciwnowotworowej jest osiągnięcie skutecznej dawki terapeutycznej ze względu na jego działanie wapniowe. Nowe VDA oznaczają, że prawdopodobnie będzie możliwa do osiągnięcia bardziej skuteczna dawka leku. Nowe VDA powstały w wyniku kompleksowego przeglądu struktury i aktywności biologicznej istniejących analogów. Zidentyfikowano korzystne modyfikacje i do syntezy jeszcze nowszych VDA potrzebne były nowe podejścia syntetyczne. Dwa z nowych analogów mają znacznie mniejsze działanie wapniowe niż 1,25D, jak przetestowano na myszach, i są o rząd wielkości bardziej aktywne niż 1,25D przeciwko liniom komórkowym ostrej białaczki szpikowej (acute myeloid leukemia; AML). Nowe VDA wiążą się z receptorem 1,25D (vitamin D receptor; VDR). Jednakże ważnym odkryciem jest to, że ich zwiększone działanie przeciwnowotworowe nie koreluje z ich powinowactwem wiązania lub siłą aktywacji transkrypcji genów docelowych dla VDR. Dlatego dokładny mechanizm ich działania pozostaje niewyjaśniony.
https://www.birmingham.ac.uk/generic/decide
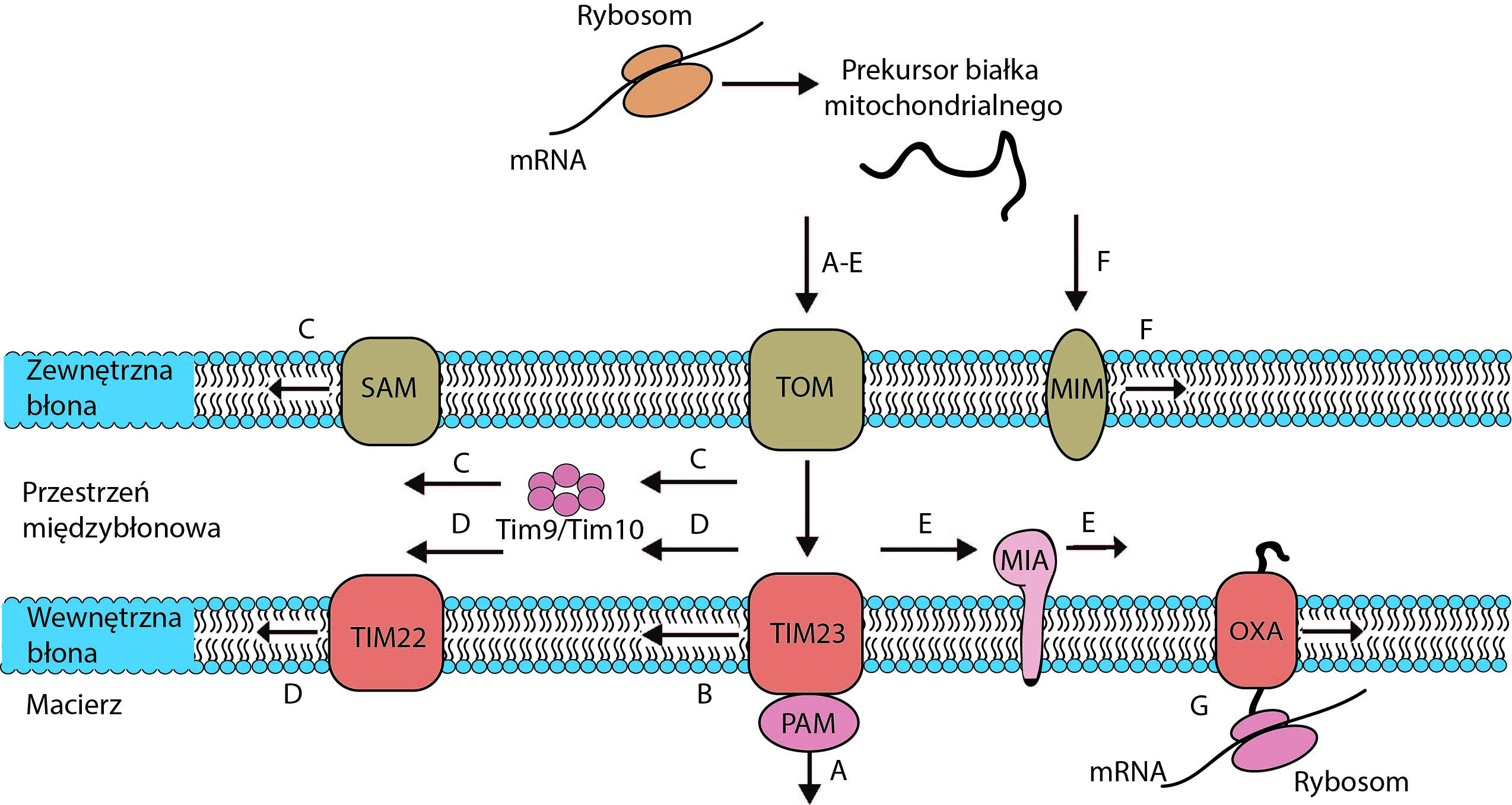
Mitochondrial protein biogenesis: transport of multi-spanning membrane proteins to mitochondria
Projekt badawczy/stypendium badawcze EMBO LTF (Europejska Organizacja ds Biologii Molekularnej) EMBO ALTF-948-2012 (2013-2015), kierownik-prof. dr hab. Łukasz Opaliński
Mitochondria to autonomiczne organelle, które odgrywają centralną rolę w metabolizmie komórkowym, produkcji ATP i regulacji śmierci komórkowej przez apoptozę. Zdecydowana większość białek mitochondrialnych jest kodowana przez genom jądrowy, syntetyzowana na rybosomach cytozolowych i dostarczana do organelli docelowej. Do tej pory scharakteryzowano pięć głównych szlaków importu białek do mitochondriów. Cztery z nich mogą transportować hydrofobowe, wielowarstwowe białka błony mitochondrialnej. Aby zapobiec agregacji hydrofobowych prekursorów w cytozolu i zapewnić ich wydajny transport do błon mitochondrialnych, prekursory są kierowane na powierzchnię organelli przez białka cytozolowe. Jednak skład cytozolowych form transportu białek błony mitochondrialnej i mechanizm, za pomocą którego prekursory docierają do mitochondriów, są w dużej mierze nieznane. Celem tego projektu jest zidentyfikowanie i scharakteryzowanie cytozolowych form transportu różnych typów wielowarstwowych białek prekursorowych mitochondriów i ich interakcji z mitochondriami.
